RELASI EFISIENSI TERMAL DAN RASIO KOMPRESI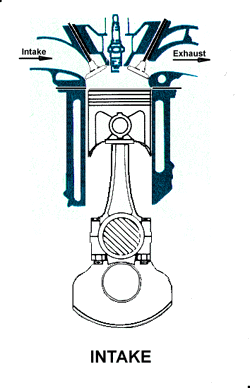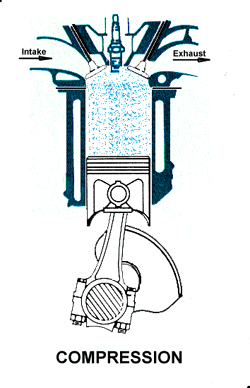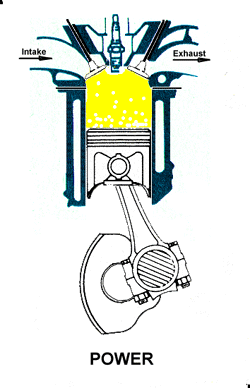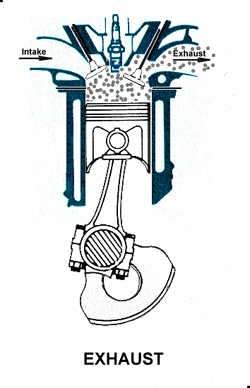
Merujuk kpd uraian sebelumnya diatas, krn
TE = [1 - (T4 - T1) / (T3 - T2)] x 100%
dan
CR = V2 / V1 = (T3 - T2) / (T4 - T1)
shg
TE = (1 - 1 / CR) x 100%
Seluruh formulasi dan kalkulasi diatas menggunakan aproksimasi ideal dimana panas jenis (spesific heat) dianggap bernilai smdgn 2.
Jika, panas jenis diperhitungkan, maka formula efisiensi termal real menjadi
TE = [1 - 1 / CR^(h-1)] x 100%
dimana h adalah panas jenis gas campuran udara dan bahanbakar, yg mana utk nilai h = 2,
TE = (1 - 1 / CR) x 100%
Jika CR = 9 dan h = 1,5 [utk udara, nilai h mendekati 1,4], maka
TEi = (1 - 1 / 9) x 100% = 0,889 x 100% = 88,9%
TEr = [1 - 1 / [9^(1,5 - 1)]] x 100% = (1 - 1 / 9^0,5) x 100% = (1 - 1/3) x 100% = (1 - 0,333) x 100% = 0,666 x 100% = 66,6%
Rasio kompresi mesin Suzuki Thunder, berdasarkan data spesifikasi teknik, adalah 9,2, berarti efisiensi termal mesin Suzuki Thunder adalah
TEi = (1 - 1/9,2) x 100% = 0,891 x 100% = 89,1%
TEr = [1 - 1 / [9.2^(1,5 - 1)]] x 100% = (1 - 1 / 9.2^0,5) x 100% = (1 - 1/3,033) x 100% = (1 - 0,33) = 0,67 x 100% = 67%
Kembali pd pernyataan pertama diatas bahwa hampir seluruh kalkulasi diatas menggunakan aproksimasi ideal, namun dlm kenyataan, pd mesin pembakaran dalam 4-tak dgn bahanbakar bensin, banyak faktor lain mesin yg mempengaruhi keseluruhan proses, shg menurunkan efisiesi termal mesin, al.
* 1. dinding silinder adalah bukan metal ideal, shg ada tenaga panas hilang krn penyerapan panas oleh metal dinding silinder.
* 2. gesekan|friksi antara bagian2 mesin tdk nol krn mesin menggunakan oli | minyak pelumas bukan ideal shg tak ada tenaga gerak hilang utk mengatasi gesekan.
* 3. udara yg memasuki silinder mesin, tak berlaku sbg gas ideal yg memiliki kapasitas panas tetap, dimana panas jenis (specific heat) 1,4, dan dimana gas campuran udara dan bahanbakar dlm silinder mengalami turbulensi|gejolak.
* 4. mesin, dlm prakteknya, tak selalu dlm status "idle", tanpa beban, kendaraan tak diam alias bergerak, shg ada akselerasi|percepatan dan dekselerasi|perlambatan dlm gerak mesin, shg seluruh proses adalah tak "quasi-static" alias berlangsung dgn perubahan labil.
Jadi, dlm praktek, secara teknis, mesin dgn efisiensi antara 60% s/d 70% sdh dianggap cukup efisien, atau memiliki efisiensi normal.
Efisiensi termal mesin dpt ditingkatkan dgn bbrp cara,al.
* 1. meningkatkan rasio kompresi antara 9 dan 10 [hrs turun mesin].
* 2. meningkatkan suhu penyalaan dan pembakaran via peningkatan tegangan elektroda busi, dgn cara menambahkan SPB (spark-plug booster) antara koil dan busi, dan mengganti busi dgn yg lbh tahan panas.
* 3. meniadakan endapan kerak arang|karbon dlm ruang silinder mesin, dgn cara meningkatkan pembakaran menjadi lbh sempurna, al via cara 2.
* 4. melapisi permukaan metal mesin dgn bahan gel anti-friksi [minimasi friksi].
* 5. meningkatkan nilai kekentaan|viskositas oli | minyak pelumas, dgn mengganti pelumas dgn yg memiliki viskositas lbh kental pd suhu tinggi.
* 6. meningkatkan nilai oktan bahanbakar, shg tak terjadi pembakaran dini (pre-ignition) yg menimbulkan letupan (detonation) dan ketukan (knocking) pd mesin,
dgn cara mengganti bahanbakar dgn yg memiliki nilai oktan lbih tinggi [tapi tentu dgn harga lbh mahal].
* 7. melumasi dgn baik seluruh bagian bergerak | mekanisme kendaraan, dan memelihara agar tekanan angin ban selalu pd ukuran tepat [ini juga minimasi friksi].
Tuesday, May 06, 2008
SIKLUS MESIN 4-TAK (Bagian Sepuluh)
Posted by Nanang Suryana at 10:08 AM 0 comments
Labels: konversi energi
SIKLUS MESIN 4-TAK (Bagian Sembilan)
FORMULASI DAN KALKULASI RASIO KOMPRESI MESIN
Merujuk kpd uraian sebelumnya diatas, dari relasi 6 fase termodinamik siklus Otto mesin 4-tak diatas, diperoleh bahwa
V2 / V1 = T2 / T1 = T3 / T4
dan juga bisa diperoleh bahwa
(T2 - T1) / T2 = (T3 - T4) / T3
atau
1 - T1/T2 = 1 - T4/T3
Nilai perbandingan V2 / V1 adalah rasio ekspansi|pemuaian (expansion ratio, XR, Rx) atau rasio kompresi|pemampatan (compression ratio, CR, Rc) isentropik volume silinder.
Berdasarkan dua relasi diatas diperoleh bahwa
CR = V2 / V1 = (T3 - T2) / (T4 - T1)
Dgn kata lain, rasio ekspansi atau rasio kompresi isentropik volume silinder adalah perbandingan volume total silinder dan volume kamar bakar (combustion chamber}, yg mana setara dgn perbandingan beda suhu pemampatan dan beda suhu pembuangan.
Utk lbh jelas, silahkan lihat kembali ilustrasi dlm diagram PVT.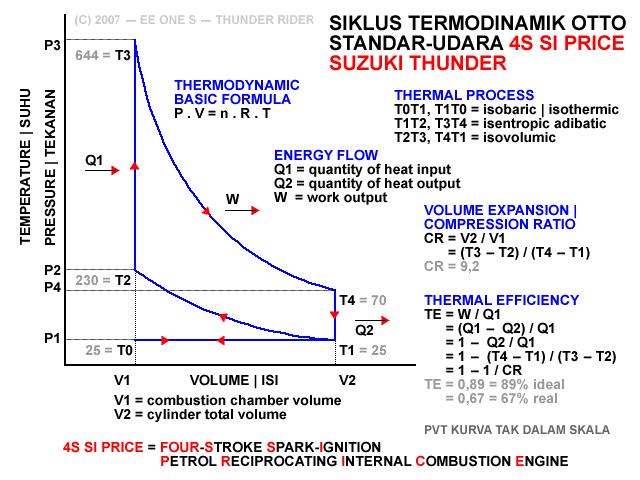
Dlm kenyataan, pd mesin pembakaran dalam 4-tak dgn bahanbakar bensin, rasio kompresi tak dapat dibuat lbh besar drpd 10, krn jika rasio kompresi lbh besar drpd 10, maka peningkatan suhu dlm proses kompresi gas campuran udara dan bahanbakar akan dpt memanaskan dan membakar gas tsb sebelum gas tsb dibakar oleh percikan listrik busi, shg menimbulkan penyalaan dini (premature ignition) atau pra-penyalaan (pre-ignition) shg terjadi letupan (detonation) yg menimbulkan suara ketukan (knocking) dan gelitik (pinking) pd mesin.
Posted by Nanang Suryana at 10:07 AM 0 comments
Labels: konversi energi
SIKLUS MESIN 4-TAK (Bagian Delapan)
FORMULASI DAN KALKULASI EFISIENSI TERMAL VIA BEDA TEMPERATUR
Merujuk kpd uraian sebelumnya diatas, aliran tenaga panas masukan|input Q1 berlangsung selama proses pemanasan dan penyalaan dan pembakaran dalam garis T2-T3 dan tenaga panas keluaran|output Q2 berlangsung selama proses pendinginan dan pembuangan T4-T1.
Relasi termodinamik menunjukkan bahwa kuantitas tenaga panas Q1 dan Q2 memiliki hubungan langsung dengan suhu panas T2 dan T3 dan T4 dan T1, dimana kuantitas tenaga panas masukan|input Q1 dgn perubahan suhu pemanasan T2 dan T3, dan kuantitas tenaga panas keluaran|output Q2 dgn perubahan suhu pendingan T4 dan T1.
Proses pemasukan|pengambilan gas campuran bahanbakar dan udara dlm garis T0-T1, dan proses pengeluaran|pembuangan sisa gas pembakaran dlm garis T1-T0, bukan merupakan sistem tertutup termodinamik (thermodynamic closed system), tp sistem terbuka termodinamik (thermodynamic open system), shg bukan merupakan bagian inti dr konversi energi dlm siklus Otto yg merupakan sistem tertutup termodinamik. Dua proses ini mengambil tenaga|energi mesin shg mengurangi efisiensi.
Relasi termodinamik menunjukkan bahwa efisiensi termal (thermal efficiency TE, Et) siklus Otto dlm sistem ini adalah, persentasi perbandingan kuantitas tenaga mekanik keluaran (mechanical energy quantity output) dan kuantitas tenaga panas masukan (heat energy quantity input), yg bila dijabarkan secara matematik fisika adalah sbb.
TE = W / Q1 x 100% = [(Q1 - Q2) / Q2] x 100% = [1 - Q2 / Q1] x 100%
dimana jika W = Q1 atau Q2 = 0, maka efisiensi 100%.
Jika dinyatakan hubungan dalam suhu, maka
TE = [1 - (T4 - T1) / (T3 - T2)] x 100%
shg efisiensi termal setara dgn persentasi satu dikurangi perbandingan beda suhu pembuangan dan beda suhu pemampatan.
Tp ini adalah formula aproksimasi gas ideal. Utk gas real berlaku formula sbb.
TE = [1 - [(T4 - T1) / (T3 - T2)]^(h-1)] x 100%
dimana h adalah panas jenis gas campuran udara dan bahanbakar, yg mana utk nilah h = 2,
TE = [1 - (T4 - T1) / (T3 - T2)] x 100%
Sbg contoh, suhu pemasukan gas campuran bahanbakar dan udara T1 adalah sekitar 25 derajat, kemudian memanas selama kompresi menjadi T2 sekitar 230 C. Lalu ketika penyalaan dan pembakaran memanas menjadi T3 sekitar 644 C, dan kemudian mendingin selama pengeluaran menjadi T4 sekitar 70 C, sampai akhirnya kembali mencapai T1 sekitar 25 C.
Jadi, krn,
T1 = 25
T2 = 230
T3 = 644
T4 = 70
TEi = [1 - (70 - 25) / (644 - 230)] x 100% = [1 - 45 / 414] x 100% = [1 - 0,109] x 100% = 0,891 x 100% = 89,1%
TEr = [1 - [(70 - 25) / (644 - 230)]^0,5] x 100% = [1 - (45 / 414)^0,5] x 100% = [1 - 0,33] x 100% = 0,67 x 100% = 67%
dimana,
TEi = efisiensi termal ideal
TEr = efisiensi termal real
Posted by Nanang Suryana at 10:06 AM 0 comments
Labels: konversi energi
SIKLUS MESIN 4-TAK (Bagian Tujuh)
DISKUSI, FORMULASI DAN KALKULASI TERMODINAMIK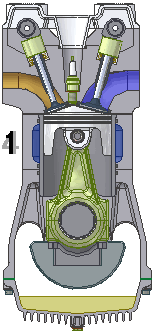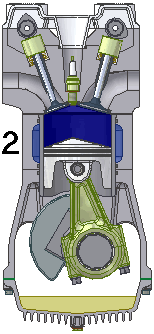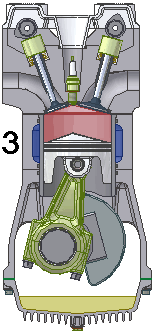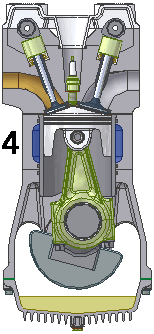
Merujuk kpd uraian sebelumnya diatas, sepasang proses isobarik T0-T1 dan T1-T0 adalah setara dan berlawanan arah, positiv dab negativ, shg secara matematik saling membatalkan satu thdp yg lain, alias hasilnya nol, shg tak perlu dilibatkan dlm perhitungan lbh lanjut. Sisanya adalah 4 proses pasangan adiabatik dan isokorik, namun hanya pasangan proses isokorik yg melibatkan penyerapan dan pelepasan tenaga panas, yakni penyerapan kuantitas tenaga panas Q1 antara T2-T3 dan pelepasan kuantitas tenaga panas Q2 antara T2-T1. Aliran panas (heat flow, heat transfer) sbg tenaga (energy) inilah yg menjadi obyek termodinamika.
Dengan asumsi bahwa kapasitas|tampungan panas adalah tetap (constant) sepanjang garis T2-T3, dan juga sepanjang garis T4-T1, diperoleh bahwa
Q1 = Ch x (T3 - T2)
Q2 = Ch x (T4 - T1)
dimana,
Q, kuantitas tenaga panas (quantity of heat energy, heat quantity).
Ch, kapasitas tenaga panas (capacity of heat energy, heat capacity).
shg diperoleh hubungan antara kuantitas tenaga panas dgn perubahan suhu,
Q2 / Q1 = T4 - T1 / T3 - T2
Posted by Nanang Suryana at 10:06 AM 0 comments
Labels: konversi energi
SIKLUS MESIN 4-TAK (Bagian Enam)
4. LANGKAH PEMBUANGAN|PENGELUARAN GAS [GARIS T4-T1 DAN GARIS T1-T0, T4 = 70 C, T1 = 25 C]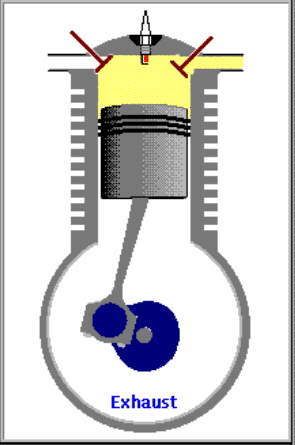

GARIS T4-T1, T4 = 70 C
4.A. Garis T4-T1 adalah garis fase proses isovolumik|isokorik quasi-statik termodimamik, menggambarkan proses pendinginan dan pengeluaran tenaga panas hasil pembakaran, ketika klep|katup keluar|buang membuka. Dlm proses ini, volume gas tetap pd V2, bobot gas campuran tetap m2, tekanan gas merosot turun dr P4 ke P1, shg suhu gas merosot turun dari T4 ke T1.
(P4 - P1) . V2 = m2 . R . (T4 - T1)
dimana gas sisa pembakaran didinginkan sampai mencapai tekanan dan suhu udara luar, shg tekanan dan suhu gas merosot sekitar 1/2,8 x lipat, 70 ke 25 derajat.
Dlm proses ini, klep|katup keluar|buang membuka, shg sistem melepaskan tenaga panas ke reservoir panas luar dgn suhu 25 C, yakni knalpot.
GARIS T1-T0, T1 = 25 C
4.B. Garis T1-T0 adalah garis fase proses isobarik quasi-statik ireversibel termodimamik, menggambarkan langkah pembuangan sisa pembakaran, piston naik, ruang silinder mengecil. Dlm proses isobarik quasi-statik ini, dimana tekanan gas P dan suhu gas T tetap dan setara tekanan atmosfir [udara luar] krn klep|katup keluar|buang terbuka. Volume silinder V mengecil dr V2 ke V1, shg bobot gas sisa pembakaran berkurang dr m2 ke m1.
P1 . (V2 - V1) = (m2 - m1) . R . T1
dimana gas sisa pembakaran mencapai tekanan dan suhu udara luar, dan dimana pada akhir proses volume dan molekul gas mendekati nol, pd tekanan dan suhu udara luar.
P1 . V1 = m1 . R . T1
Sampai disini 6 fase siklus Otto dlm siklus mesin 4-tak berakhir dan berulang kembali menjalani daur ulangnya.
Posted by Nanang Suryana at 10:05 AM 0 comments
Labels: konversi energi
SIKLUS MESIN 4-TAK (Bagian Lima)
3. LANGKAH PENYALAAN|PEMBAKARAN DAN PENDAYAAN|KONVERSI GAS [GARIS T2-T3 DAN KURVA T3-T4, T3 = 644 C DAN T4 = 70 C]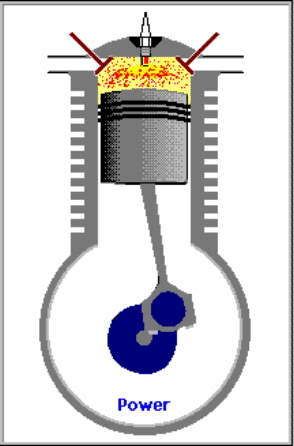
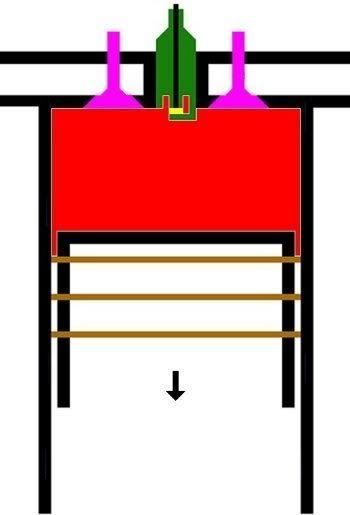

GARIS T2-T3, T3 = 644 C
3.A. Garis T2-T3 adalah garis fase proses isovolumik|isokorik quasi-statik termodimamik, menggambarkan proses pemanasan dan penyalaan dan pembakaran gas campuran bahanbakar dan udara oleh percikan busi, ketika pasangan klep|katup tertutup. Dlm proses ini, Volume gas tetap pd V1, tp krn pemanasan, tekanan gas meningkat naik dr P2 ke P3, shg suhu gas meningkat naik dari T2 ke T3.
(P3 - P2).V1 = m2 . R . (T3 - T2)
dimana gas dibakar, shg tekanan dan suhu gas meningkat sekitar 2,8 x lipat, dari 230 C ke 644 C.
Dlm proses ini, pasangan klep|katup dlm keadaan tertutup, shg tak ada gas masuk ke dan keluar dr silinder, tp silinder menyerap tenaga panas dr serangkaian reservoir panas luar dgn rangkum suhu panas dr T2 ke T3, yakni peledakan gas campuran bahanbakar dan udara oleh percikan listrik busi.
KURVA T3-T4, T4 = 70 C
3.B. Kurva T3-T4 adalah kurva fase proses adiabatik isentropik quasi-statik reversibel termodinamik, menggambarkan langkah pendayaan krn pembakaran gas campuran udara dan bahanbakar dlm silinder ketika pasangan klep|katup tertutup shg piston turun 180 derajat, ruang silinder membesar. Dlm proses adiabatik quasi-statik ini, volume silinder dan volume V membesar dr V1 ke V2, bobot gas campuran tetap m2, tekanan gas P merosot turun dr P3 ke P4, dan suhu gas T merosot turun dr T3 ke T4
(P3 - P4)(V2 - V1) = m2 . R . (T3 - T4)
dimana gas dimuaikan, shg tekanan dan suhu gas merosot sekitar 1/9,2 x lipat, dari 644 C ke 70 C.
Perubahan volume berbanding terbalik dgn perubahan suhu, krn volume membesar dan suhu merosot.
(V1 / V2)^(h-1) = T4 / T3
dimana h, panas jenis (spesific heat) gas campuran udara dan bahanbakar.
Utk aproksimasi ideal, h = 2, formula menjadi
V1 / V2 = T4 / T3
V1 . T3 = V2 . T4
Posted by Nanang Suryana at 10:03 AM 0 comments
Labels: konversi energi
SIKLUS MESIN 4-TAK (Bagian Empat)
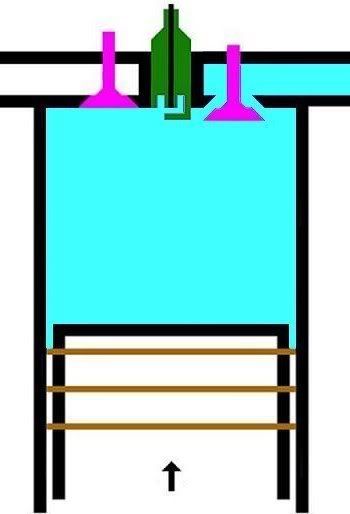
2. LANGKAH PEMAMPATAN|KOMPRESI GAS [KURVA T1-T2, T2 = 230 C]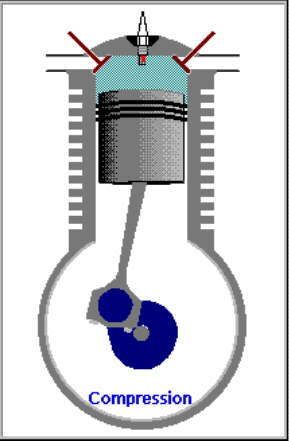
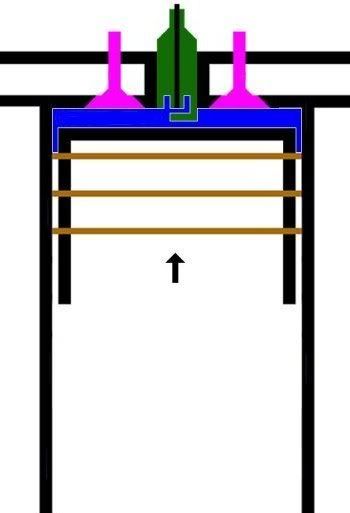

KURVA T1-T2, T2 = 230 C
Kurva T1-T2 adalah kurva fase proses adiabatik isentropik quasi-statik reversibel termodinamik, menggambarkan langkah pemampatan gas campuran udara dan bahanbakar dlm silinder ketika pasangan klep|katup tertutup dan piston naik 180 derajat, ruang silinder mengecil. Dlm proses ini, volume silinder dan volume gas V mengecil dr V1 ke V2, bobot molekul gas campuran bahanbakar dan udara tetap m2, tekanan gas P meningkat naik dr P1 ke P2, dan suhu gas T meningkat naik dr T1 ke T2
(P2 - P1).(V2 - V1) = m2.R.(T2 - T1)
dimana gas dimampatkan, shg tekanan dan suhu gas meningkat sekitar 9,2 x lipat, dari 25 C ke 230 C.
Perubahan volume berbanding terbalik dgn perubahan suhu, krn volume mengecil dan suhu meningkat.
(V1 / V2)^(h-1) = T1 / T2
dimana h, panas jenis (spesific heat) gas campuran udara dan bahanbakar.
Utk aproksimasi ideal, h = 2, formula menjadi
V1 / V2 = T1 / T2
V1 . T2 = V2 . T1
Posted by Nanang Suryana at 1:29 AM 0 comments
Labels: konversi energi
Monday, May 05, 2008
SIKLUS MESIN 4-TAK (Bagian Tiga)
1. LANGKAH PENGAMBILAN|PEMASUKAN | PENGISAPAN GAS [GARIS T0-T1, T1 = 25 C]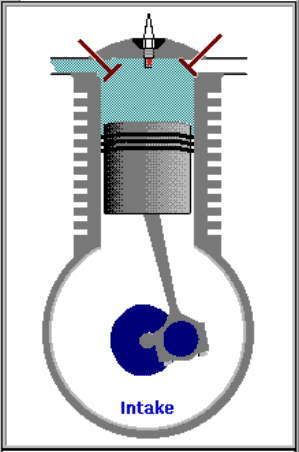
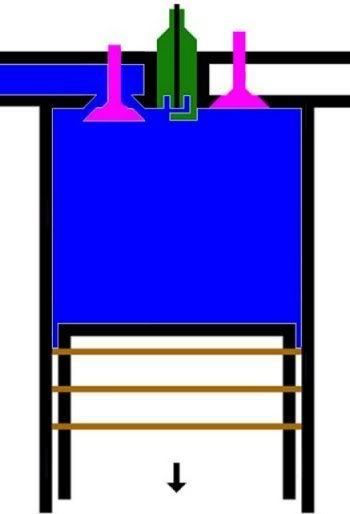

GARIS T0-T1, T1 = 25 C
Garis T0-T1 adalah garis fase proses isobarik-isotermik quasi-statik termodimamik, menggambarkan langkah pemasukan | pengambilan dan penyedotan gas campuran udara dan bahanbakar pd tekanan dan suhu tetap dr karburator ke silinder mesin, ketika klep|katup masuk|ambil membuka dan piston turun 180 derajat, ruang silinder membesar. Dlm proses ini, tekanan gas P dan suhu gas T, tetap dan setara tekanan dan suhu standar normal udara luar (normal standard atmospheric pressure and temperature), krn klep|katup masuk|ambil terbuka. Volume silinder V membesar dr V1 ke V2, shg bobot molekul gas campuran bahanbakar dan udara dlm silinder bertambah dr m1 ke m2.
P1 . (V2 - V1) = (m2 - m1). R . T1
P1 = P0 = Patm, tekanan atmosfir | udara luar
T1 = T0 = Tatm, suhu atmosfir | udara luar
m1 = mo = nol [ideal nol, praktis mendekati nol]
dimana suhu awal silinder setara suhu udara luar, sekitar 25 C.
Dlm proses ini, klep|katup masuk|ambil membuka, shg sistem menyerap tenaga panas dr reservoir panas luar dgn suhu 25 C, yakni karburator.
Posted by Nanang Suryana at 3:35 AM 0 comments
Labels: konversi energi
SIKLUS MESIN 4-TAK (Bagian Dua)
FORMULA DASAR TERMODINAMIK GAS IDEAL
Utk informasi anda saja, bagian ini mengandung batasan istilah (term definition) proses dlm termodinamika yg digunakan utk menjelaskan rangkaian proses berlangsung dlm mesin bakar bensin 4-tak, dan formula matematik fisika, dasar termodinamika, yd digunakan utk melakukan perhitungan teknik dan memperoleh kesimpulan.
Dlm sistem termodinamik ada bbrp istilah utk proses, yg dlm konteks ini, al sbb.
reversibel (reversible): proses bisa-dibalik, bisa-dikembalikan, bisa bolak-balik.
ireversibel (irreversible): proses tak bisa-dibalik.
quasi-statik (quasi-static): proses dgn statik infinitesimal, hampir statik, hampir stabil.
adiabatik (adiabatic): proses dgn aliran panas (heat flow) atau perpindahan panas (heat transfer), dimana efek kompresi adiabatik adalah pemanasan gas, dan sebaliknya, efek ekspansi adiabatik adalah pendinginan gas.
isentropik (isentropic): proses pd entropi tetap (constant entropy). Suatu proses adibatik reversibel adalah isentropik, dimana selama berlangsung perubahan adibatik, entropi tetap tak berubah.
isobarik (isobaric) atau isopiestik (isopiestic): proses pd tekanan tetap (constant pressure).
isotermik, isotermal (isothermic, isothermal): proses pd suhu tetap (constant temperature).
isovolumik, isovolumetrik (isovolumic, isovolumetric) atau isokorik (isochoric): proses pd volume tetap (constan volume).
Disini tak akan dibahas lbh lanjut ttg bbg istilah termodinamik ini, cukup hanya sbg pengetahuan dasar utk membedakan kelangsungan suatu proses termodinamik dlm mesin pembakaran dalam 4-tak dgn bahanbakar bensin akan dikupas secara rinci disini.
Berikut adalah formula dasar termodinamika.
Buat yg gerah dgn matematika, cukup sbg pengetahuan saja, dan silahkan lewatkan, dan lihat ringkasan dan kesimpulan pd bagian akhir.
Sistem termodinamik adalah merupakan fungsi 4-dimensional dlm suatu sistem tertutup,
f (P, V, T, m) = 0
dengan formula dasar keseimbangan termodinamik (themodynamic equilibrium)
P . V = m . R . T
dimana,
p = pressure (tekanan, desakan), dlm unit Pa (Pascal) atau N/m2 (Newton per square metre).
T = temperature (suhu), dlm unit K (Kelvin) atau C (Celcius, Centigrade).
V = volume (isi, kandungan), dlm unit m3 (cubic metre).
m = mass (masa, bobot), dlm unit kg (kilogramme).
R = universal gas constant (konstanta gas universal), dlm unit Pa.m3/kg.K.
Unit|satuan ukuran digunakan disini adalah unit sistem internasional (SI unit, systeme international d'unites). Dlm rekayasa termodinamik (thermodynamic engineering) digunakan satuan rekayasa Inggris (British engineering unit). Dlm uraian ini tak dibahas lbh jauh ttg unit ukuran, dan diluar cakupan tulisan ini.
Jika kandungan panas jenis gas diperhitungkan, maka formula diatas menjadi
P . V^h = m . R . T = K
dan
h = cp / cv
R = cp - cv, utk gas ideal.
dimana,
h = panas jenis (specific heat) gas, rasio tampungan|kapasitas panas jenis gas.
c = tampungan|kapasitas panas jenis (specific heat capacity) gas.
cp= c pd tekanan tetap; kapasitas panas jenis isobarik.
cv= c pd volume tetap; kapasitas panas jenis isovolumik.
C = tampungan|kapasitas panas (heat capacity, thermal capacity) gas, yakni kuantitas panas dibutuhkan utk meningkat 1 derajat suhu suatu gas.
K = tetapan|konstanta (constant).
Q = C . T
dQ = C . dT
dimana,
Q = kuantitas panas (quantity of heat, heat quantity).
dQ= perubahan kuantitas panas.
dT= perubahan suhu (temperature difference).
Q = S . T
dQ = dS . T
S = Q / T
dS = dQ /T
dimana,
S = entropi (entropy), ukuran relativ kuantitas energi tak-bisa-diperoleh dlm suatu sistem.
dS= perubahan entropi.
H = U P . V
dimana,
H = entalpi (enthalpy), kandungan panas (heat content).
U = tenaga internal (internal energy).
catatan penulisan:
tanda . atau * atau x berarti kali.
tanda ^ atau ** berarti pangkat (exponent).
tanda ^(1/2) atau **0,5 berarti pangkat setengah atau akar kuadrat (square root).
Posted by Nanang Suryana at 3:34 AM 0 comments
Labels: konversi energi
SIKLUS MESIN 4-TAK (source suzuki-thunder forum)
FASE TERMODINAMIK SIKLUS OTTO DALAM SIKLUS MESIN 4-TAK,
FORMULASI DAN KALKULASI RASIO KOMPRESI DAN EFISIENSI TERMAL MESIN,
DAN EFEK NUFTON SPB TERHADAP KINERJA MESIN
BAGIAN PERTAMA
Perilaku mesin bensin 4-tak dpt dijabarkan dlm termodinamika menggunakan formula matematika fisika sederhana.
Untuk menyederhanakan masalah dan memudahkan perhitungan, dilakuan pendekatan dgn pengandaian keadaan ideal, sbb.
1. dinding silinder adalah metal ideal, shg tak ada tenaga panas hilang krn penyerapan panas oleh metal dinding silinder.
2. gesekan|friksi antara bagian2 mesin dianggap nol atau mendekati nol krn mesin menggunakan oli | minyak pelumas ideal shg tak ada tenaga gerak hilang utk mengatasi gesekan.
3. udara yg memasuki silinder mesin, berlaku sbg gas ideal yg memiliki kapasitas panas tetap, dimana koeefisien panas jenis (specific heat) dianggap smdgn 2.
4 mesin dlm status "idle", tanpa beban, kendaraan diam, shg tak ada akselerasi|percepatan dan dekselerasi|perlambatan dlm gerak mesin, shg seluruh proses adalah "quasi-static" alias berlangsung dgn perubahan stabil penuh.
Dgn menggunakan semua asumsi diatas, siklus mesin 4-tak dpt dijabarkan dlm termodinamika sbg 6 fase siklus Otto standar-udara (air-standard Otto Cycle), yg terdiri dari 6 proses sederhana gas ideal, sbb.
1.X. pengambilan|pemasukan | penyedotan gas [campuran bahanbakar dan udara].
2.X. pemampatan|kompresi gas
3.A. pemanasan dan pembakaran gas
3.B. pendayaan|konversi gas, dr tenaga panas ke tenaga gerak.
4.A. pendinginan gas sisa pembakaran.
4.B. pembuangan|pengeluaran gas sisa pembakaran.
6 fase siklus Otto ini dpt digambarkan dlm diagram PVT (pressure, volume, temperature; tekanan, isi, suhu) 3-dimensi, atau diagram PV 2-dimensi sbb.
dimana, masing2 proses digambarkan dgn garis PVT atau kurva PVT.
1.X. garis. T0-T1
2.X. kurva T1-T2
3.A. garis. T2-T3
3.B. kurva T3-T4
4.A. garis. T4-T1
4.B. garis. T1-T0
Lihat gambar.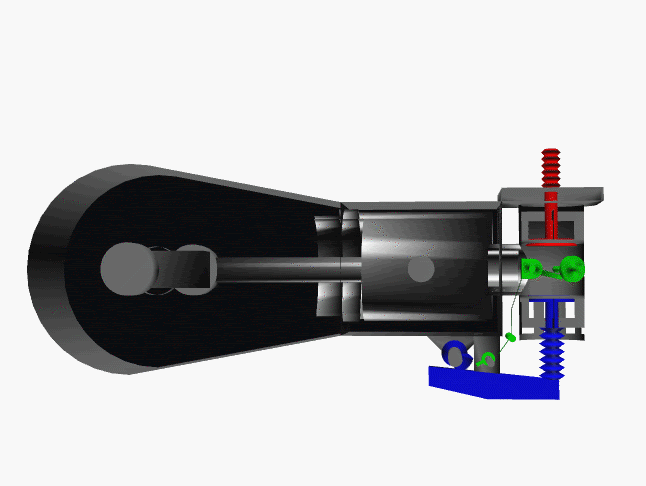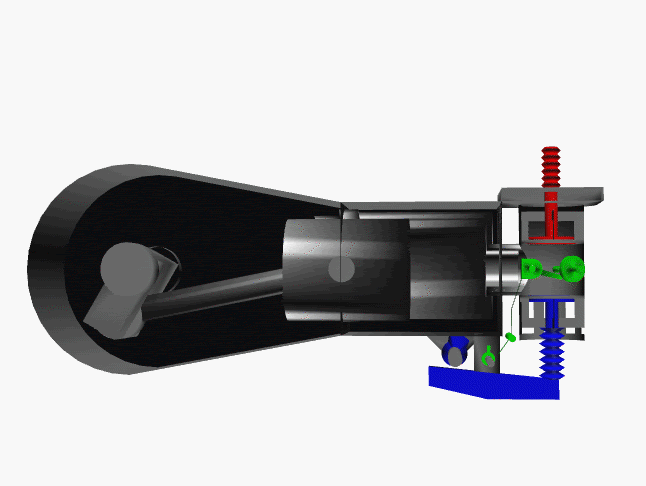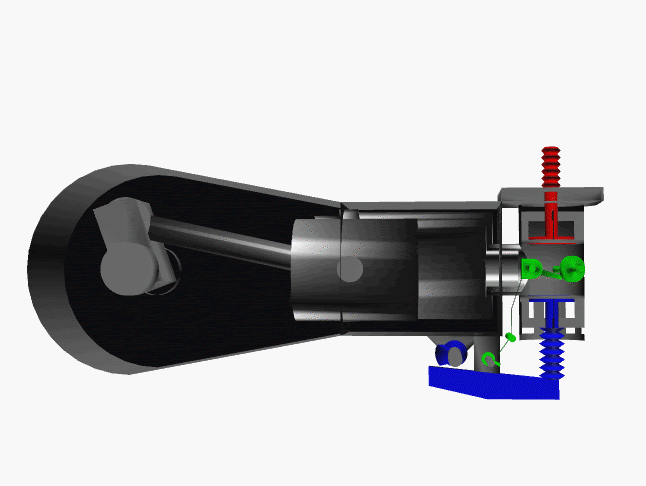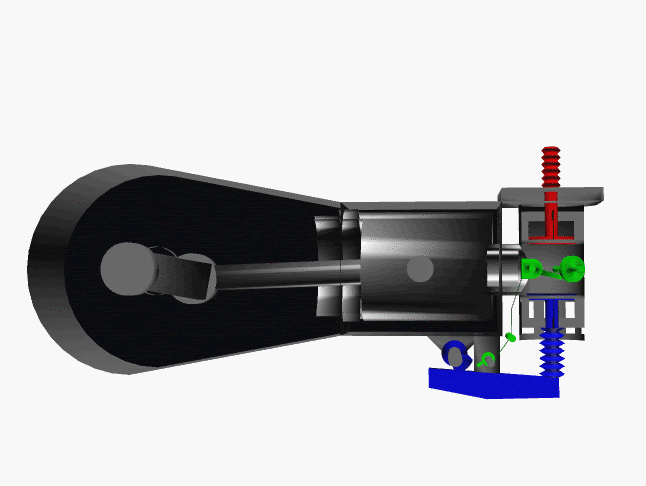
Posted by Nanang Suryana at 3:27 AM 0 comments
Labels: konversi energi
Membuat Sendiri Command Aliases AutoCAD
Salah satu kemudahan dalam AutoCAD adalah kita bisa menggunakan banyak cara untun memasukan perintah. Kita bisa menggunakan command line, toolbar, maupun menu.
Bagi yang sudah lama menggunakan AutoCAD tertuama dari mulai versi DOS, tentu sangat terbisa untuk menginput perintah AutoCAD melalui keyboard. Bagi pengguna baru pun sangatlah baik bila membiasakan diri menggunakan keyboard sebagai input utama. Pengguna AutoCAD dapat menggunakan kedua tangannya secara efektif yakni tangan kiri pada keyboard dan tangan kanan pada mouse, atau sebaliknya bagi para pengguna kidal/ left handed.
AutoCAD memberikan kemudahan untuk setiap command yang diinput melalui kerboard berupa AutoCAD Commad Ailases. Pengguna hanya menginput sedikit hurup saja untuk menggantikan perintah aslinya yang terkadang cukup panjang.
Misalnya pada perintah untuk membuat garis, maka pengguna cukup menginput “L” untuk menggantikan “LINE” atau “C” untuk menggantikan “CIRCLE”. AutoCAD akan menterjemahkan huru L tersebut sebagai alias perintah LINE begitu pula dengan C sebagai alias perintah CIRCLE.
Kita dapat melihat konfigurasi alias perintah yang terdapat pada AutoCAD. Pada versi-versi yang lebih baru, biasanya disediakan sendiri fasilitas yang disebut dengan AutoCAD Command Aliases Editor. Untuk panduannya kita dapat mencari pada search index yang tersedia pada menu HELP. Untuk versi AutoCAD yang lebih tua, kita harus mengedit secara manual pada file acad.pgp. Cara ini juga dapat digunakan pada versi terbaru.
Bukalah file acad.pgp yang biasanya tersimpan pada direktori dimana kita menginstall AutoCAD. Pada versi 2006 kita dapat dengan mudah membuka file ini melalui menu Tools > Customize > Edit Program Parameter (acad.pgp).
Komputer akan memanggil file acad.pgp melalui Notepad.
Kita dapat melhat alias-alias standar untuk perintah-perintah yang sudah ada. Dengan mengikuti format yang sama kita dapat menambahkan alias perintah yang baru. Misalnya kita akan manambahkan command alias KOTAK atau KO untuk RECTANGLE.
Tips: Sebelum mencoba, buatlah file acad.pgp cadangan untuk berjaga-jaga dan mempermudah ketika akan mengembalikan ke setingan awal.
Setelah menambahkan alias perintah yang baru, simpanlah file acad.pgp tersebut (save), kemudian restart program AutoCAD agar setingan tersebut dapat dipanggil.
Cobalah apakah alias perintah yang kita buat dapat digunakan.
Selamat mencoba !!!!
Posted by Nanang Suryana at 3:25 AM 0 comments
Labels: autocad
Persamaan Navier-Stokes
Persamaan Navier-Stokes (dinamakan dari Claude-Louis Navier dan George Gabriel Stokes) adalah serangkaian persamaan yang menjelaskan pergerakan dari suatu fluida seperti cairan dan gas. Persamaan-persamaan ini menyatakan bahwa perubahan dalam momentum (percepatan) partikel-partikel fluida bergantung hanya kepada gaya viskos internal (mirip dengan gaya friksi) dan gaya viskos tekanan eksternal yang bekerja pada fluida. Oleh karena itu, persamaan Navier-Stokes menjelaskan kesetimbangan gaya-gaya yang bekerja pada fluida.
Persamaan Navier-Stokes memiliki bentuk persamaan diferensial yang menerangkan pergerakan dari suatu fluida. Persaman seperti ini menggambarkan hubungan laju perubahan suatu variabel terhadap variabel lain. Sebagai contoh, persamaan Navier-Stokes untuk suatu fluida ideal dengan viskositas bernilai nol akan menghasilkan hubungan yang proposional antara percepatan (laju perubahan kecepatan) dan derivatif tekanan internal.
Untuk mendapatkan hasil dari suatu permasalahan fisika menggunakan persamaan Navier-Stokes, perlu digunakan ilmu kalkulus. Secara praktis, hanya kasus-kasus aliran sederhana yang dapat dipecahkan dengan cara ini. Kasus-kasus ini biasanya melibatkan aliran non-turbulen dan tunak (aliran yang tidak berubah terhadap waktu) yang memiliki nilai bilangan Reynold kecil.
Posted by Nanang Suryana at 3:23 AM 1 comments
Labels: fluida
Hipotesis Kontinum
Fluida disusun oleh molekul-molekul yang bertabrakan satu sama lain. Namun demikian, asumsi kontinum menganggap fluida bersifat kontinu. Dengan kata lain, properti seperti densitas, tekanan, temperatur, dan kecepatan dianggap terdefinisi pada titik-titik yang sangat kecil yang mendefinisikan REV (‘’Reference Element of Volume’’) pada orde geometris jarak antara molekul-molekul yang berlawanan di fluida. Properti tiap titik diasumsikan berbeda dan dirata-ratakan dalam REV. Dengan cara ini, kenyataan bahwa fluida terdiri dari molekul diskrit diabaikan.
Hipotesis kontinum pada dasarnya hanyalah pendekatan. Sebagai akibatnya, asumsi hipotesis kontinum dapat memberikan hasil dengan tingkat akurasi yang tidak diinginkan. Namun demikian, bila kondisi benar, hipotesis kontinum menghasilkan hasil yang sangat akurat.
Masalah akurasi ini biasa dipecahkan menggunakan mekanika statistik. Untuk menentukan perlu menggunakan dinamika fluida konvensial atau mekanika statistik, angka Knudsen permasalahan harus dievaluasi. Angka Knudsen didefinisikan sebagai rasio dari rata-rata panjang jalur bebas molekular terhadap suatu skala panjang fisik representatif tertentu. Skala panjang ini dapat berupa radius suatu benda dalam suatu fluida. Secara sederhana, angka Knudsen adalah berapa kali panjang diameter suatu partikel akan bergerak sebelum menabrak partikel lain.
Posted by Nanang Suryana at 3:22 AM 1 comments
Labels: fluida
Sekilas Mengenai Mekanika Fluida
Mekanika fluida adalah displin ilmu yang mempelajari fluida (yang dapat berupa cairan dan gas). Mekanika fluida dapat dibagi menjadi fluida statik dan fluida dinamik. Fluida statis mempelajari fluida pada keadaan diam sementara fluida dinamis mempelajari fluida yang bergerak.
Dalam pandangan secara mekanis, sebuah fluida adalah suatu substansi yang tidak mampu menahan tekanan tangensial. Hal ini menyebabkan fluida pada keadaan diamnya berbentuk mengikuti bentuk wadahnya.
Seperti halnya model matematika pada umumnya, mekanika fluida membuat beberapa asumsi dasar berkaitan dengan studi yang dilakukan. Asumsi-asumsi ini kemudian diterjemahkan ke dalam persamaan-persamaan matematis yang harus dipenuhi bila asumsi-asumsi yang telah dibuat berlaku.
Mekanika fluida mengasumsikan bahwa semua fluida mengikuti:
* Hukum kekekalan massa
* Hukum kekekalan momentum
* Hipotesis kontinum, yang dijelaskan di bagian selanjutnya.
Terkadang, akan lebih bermanfaat (dan realistis) bila diasumsikan suatu fluida bersifat inkompresibel. Maksudnya adalah densitas dari fluida tidak berubah ketika diberi tekanan. Cairan terkadang dapat dimodelkan sebagai fluida inkompresibel sementara semua gas tidak bisa.
Selain itu, terkadang viskositas dari suatu fluida dapat diasumsikan bernilai nol (fluida tidak viskos). Terkadang gas juga dapat diasumsikan bersifat tidak viskos. Jika suatu fluida bersifat viskos dan alirannya ditampung dalam suatu cara (seperti dalam pipa), maka aliran pada batas sistemnya mempunyai kecepatan nol. Untuk fluida yang viskos, jika batas sistemnya tidak berpori, maka gaya geser antara fluida dengan batas sistem akan memberikan resultan kecepatan nol pada batas fluida.
Posted by Nanang Suryana at 3:21 AM 0 comments
Labels: fluida



